
물분자를 꺽쇠 모양으로 굽혀놓는 보이지 않는 것들
이전에 물의 구조에 대해 조사해 보면서 물분자를 굽은모양으로 만드는데에 중심 산소의 두 개의 비공유 전자쌍이 기여를 한다고 배웠다. 어떤 이유에서 음전하를 띤 전자들끼리 굳이 둘씩 짝지어 쌍으로 존재한다고 과학자들이 말하고 있는지 궁금해서 이번기회에 further study를 해보았다.
생명의 어머니, 물의 성질
카타라 : 물을 이렇게 밀었다가 당겨봐. 비결은 팔목을 잘 쓰는거야. 아앙 : 이렇게? (워터밴딩으로 냇물을 조종하는 아앙) - 애니 중에서 - 지표와 생물의 대부분을 차지하는 물 인류를 비롯한 모
hephaestusian.tistory.com
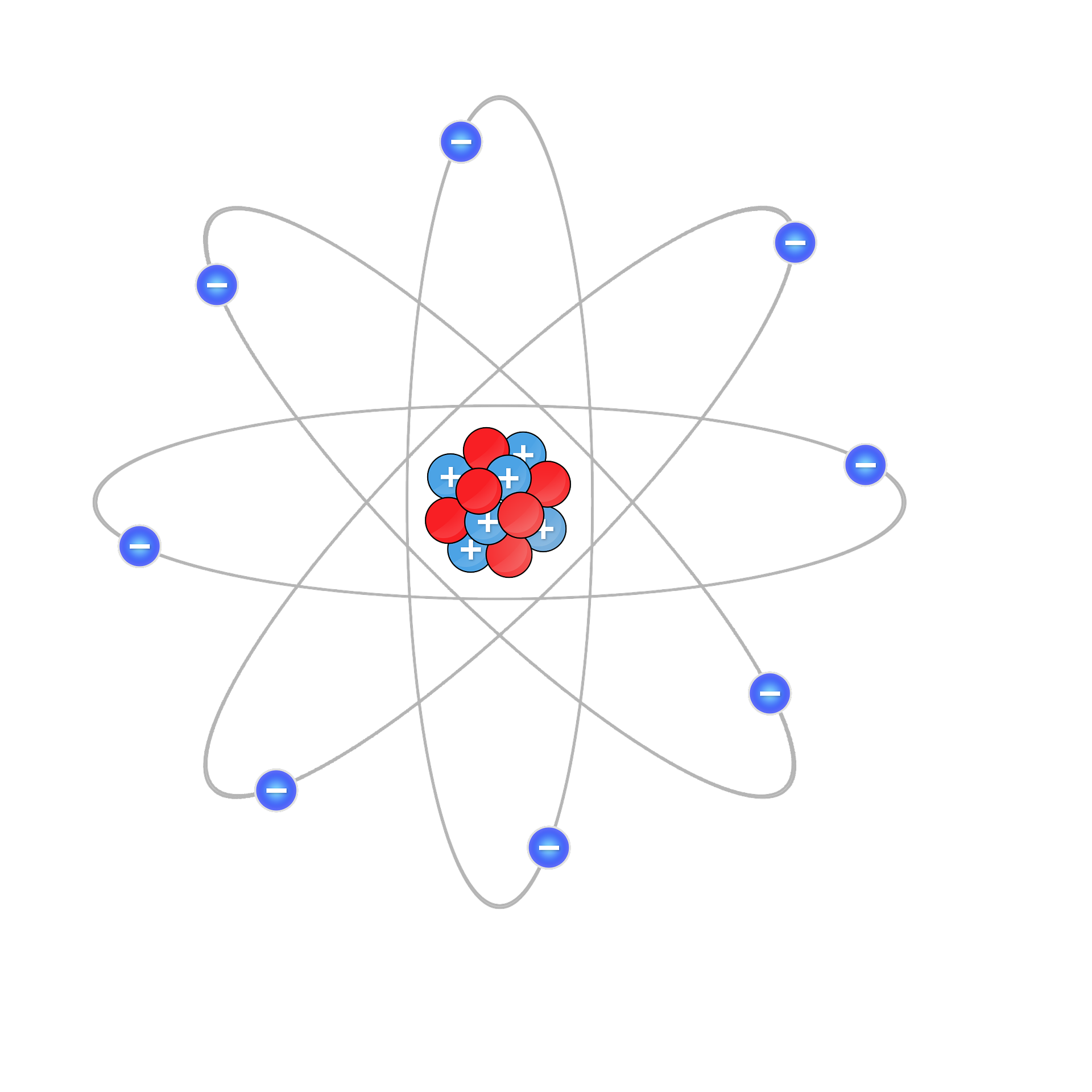
전자에 작용하는 힘
원자의 모습을 떠올리면 현대물리학에서 이야기하는 전자의 위치와 운동량이 결정되지 않은 모습은 상상하기 힘들다. 일반적으로는 고전물리학에서 나타내던 핵을 중심으로해서 그 주위를 전자가 빙글빙글 도는 모습을 상상한다(러더퍼드의 모델). 이는 태양을 중심으로 행성이나 소행성들이 공전하는 모습과 유사하다. 이렇게 생각하더라도 드라마틱한 상상력이 아니라면 물질에서 일어나는 변화를 파악하는데 큰 문제는 없다고 한다. 기본적으로 전자의 상태에 작용하는 두 가지의 힘이 잘 표현되어있기 때문이다. 첫번째는 원자핵의 양전하와 전자의 음전하가 서로 끌어당기는 힘이고 두번째는 전자들의 음전하가 서로 밀어내는 힘이있고 이것이 균형을 이룬 상태로 원자가 존재한다는 것이다.

그러면 모든 전자가 서로 최대한 밀어내는 먼 위치로 존재해야 하는것 아닌가?
물분자의 경우 중심 산소에 수소 두개가 각각 공유결합을 형성하면서 최외각 전자 6개중 4개가 결합되지 않고 산소원자에 붙들려있다. 위에서 설명한 두 가지 힘 뿐이라면 공유결합들이 차지하는 공간을 제외하고 최대한 서로 밀어내는 힘을 덜받도록 존재하는 것이 자연스럽다(누가 억지로 전자를 불편하게 밀어붙이지 않기 때문이다). 이렇게되면 물분자의 모습은 아래 그림과 같이 되겠지만 사실은 두 전자끼리 쌍으로 존재하여 꺽쇠모양으로 존재한다.

전자는 존재하는 궤도가 따로있다?
직관적으로 전자가 원자핵을 중심으로 빙글빙글 돈다고 생각하면 마구잡이로 도는것처럼 생각되지만 과학자들은 전자의 파동으로서의 성질도 함께 고려하면서 전자가 하나의 파동이라고 가정하고 방정식을 설계하였다. 그 방정식 안에있는 파동함수, 즉 궤도함수(오비탈)를 통해 전자가 존재할 수 있는 위치를 예측하고 현대 양자모형에서 이 오비탈이 전자의 모습으로서 도입되었다.
드브로이는 전자가 입자라는 아인슈타인의 주장에 반기를 들고 전자가 파동과 입자의 성질을 모두 지녔다는 물질파이론을 개념화하였다. 오스트리아의 물리학자인 슈뢰딩거는 전자가 파동의 성질을 지녔다는 개념을 바탕으로 원자구조를 풀어내려하였다. 슈뢰딩거와 드브로이는 전자가 핵을 중심으로 정상파와 유사하게 행동한 것으로 보고, 원자를 파동 역학적으로 기술하였다.
수소의 전자가 정류파라고 가정하고 실험한 결과, 수소원자는 파장의 정수배에 해당하는 에너지만을 가지고 있었으며 이는 수소원자가 양자화되었음을 보여준다. 슈뢰딩거는 이를 바탕으로 전자가 정류파처럼 행동한다고 확신하였고 양자화 된 수소원자를 설명하는 모형을 고안해냈다.
1920년에는 이미 정류파에 대한 물리적 원리들이 잘 알려진 상태였다. 슈뢰딩거는 초기에는 자신의 이론이 타당한지 확신을 가지지 못하였지만 수소를 포함한 다른 원자들의 실험 결과가 자신이 주장한 원자모양을 가지고 수학적으로 계산이 가능하였음을 입증하였다. 그가 원자모형을 계산한 방정식을 ‘슈뢰딩거 방정식’이라고 부르며, 그 형태는 다음과 같다.
Ĥψ=Eψ
여기서 ψ는 파동함수, 즉 삼차원공간 x,y,z축 에 대한 전자의 위치를 좌표로 나타낸 함수를 의미한다. Ĥ는 연산자인데 이는 수학적인 지시 사항으로 연산자의 수식항들을 파동함수에 대입하면 원자의 전체 에너지를 구할 수 있다. - 위키백과 -
입자와 파동의 성질을 동시에 가진 전자는 특정한 궤도안에 존재하게 되고 이 궤도는 양자 수라고 알려진 정수로 고유하게 정의될 수 있다. 양자수에 대한 내용도 매우 길어지기에 정의만 소개하고자 한다.
양자수(量子數, quantum number)는 양자계를 묘사하기 위해 쓰이는 수다. 양자화되어, 대개 정수거나 반정수(half-integer)다. 많은 경우 원자 안에서의 전자의 에너지 등을 묘사하며, 그 외에도 각운동량이나 스핀 등에 대한 정보를 담기도 한다. 전자를 완전히 설명할 수 있는 양자수에는 총 네 가지가 있다.
- 주 양자수(principal quantum number)
- 방위 양자수(azimuthal quantum number)
- 자기 양자수(magnetic quantum number)
- 자기 스핀 양자수(magnetic spin quantum number)
대체 이것들이 전자가 쌍으로 존재한다는 말과 무슨 관계란 말인가?
전자가 궤도로서 존재한다는 것은 알았는데 쌍으로 존재하는것과 무슨관계길래 이런 설명을 하는것인가 싶다. 하지만 이제거의 다왔다. 앞선 내용을 통해 전자는 최대한 안정적인 상태를 추구하고 음전하를 가진 전자는 서로 반발하여 밀어내며, 존재하더라도 파동의 성질에 의해 궤도로서 존재한다는 사실을 알아냈다. 그러면 이제 물분자에서 전자들이 어떤 궤도에 존재해야 하는지를 알아야 한다.
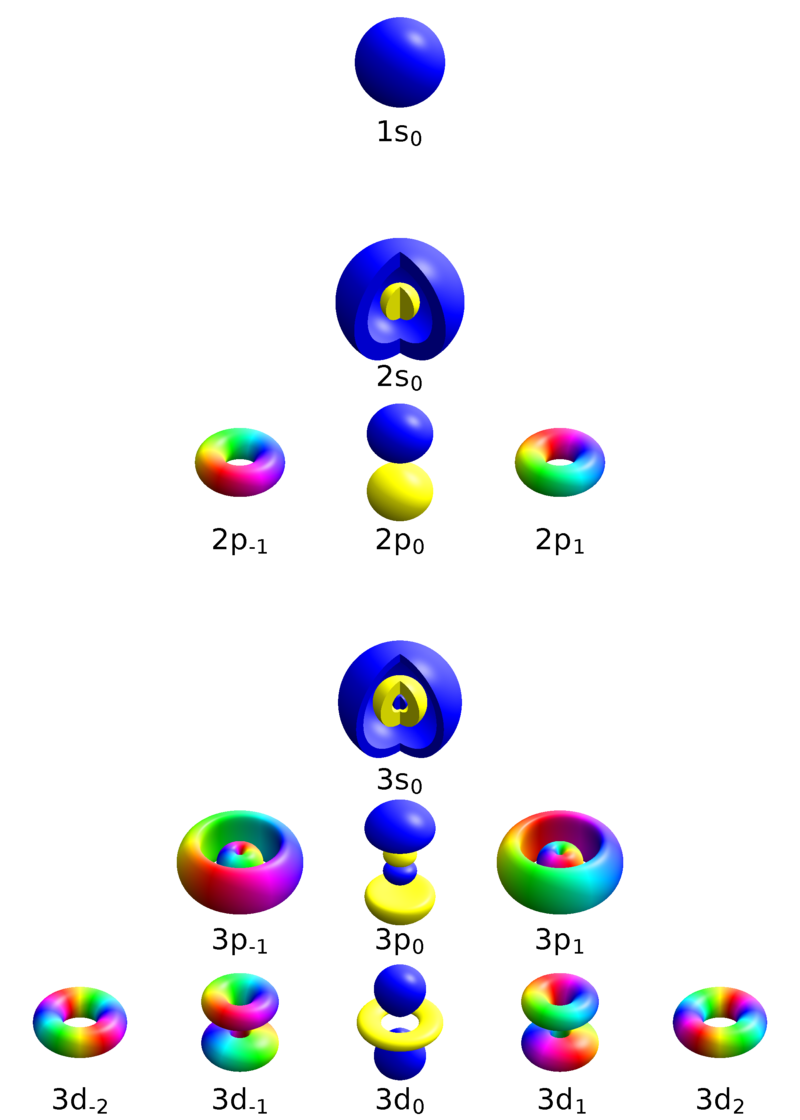
물분자에서 전자의 오비탈
산소의경우 전자를 8개 가지고 있는데 가장 에너지 준위가 낮은 궤도로 전자가 먼저 존재한다. 따라서 1s 궤도에 2개, 2s 궤도에 2개, 2p 궤도에 4개의 전재가 존재한다(파울리 배타 원리에 의해 한 오비탈에 전자는 최대 2개까지만 들어갈 수 있다. 자세한 내용은 링크 참조). 에너지 준위가 매우 낮은 1s에 있는 전자들은 다른 바깥궤도로 올라오려면 아주 높은 에너지가 필요하기 때문에 2s와 2p의 6개의 전자만 일반적으로 화학반응에 작용한다. 2s와 2p의 궤도는 에너지준위가 다른데(2p가 더 높다) 물분자의 전자들은 2s궤도와 2p 궤도가 합쳐진 sp3혼성 오비탈 4개를 형성한다(에너지준위는 2s보다 높고 2p보다 낮으면서 sp3 궤도에). 결국 물분자의 산소만 독립적으로 봤을때 sp3 4개의 궤도중에 2개에 전자 2개씩, 나머지 2개에 전자 1개씩 차지하고 있는 모습을 보이게 된다(실제로 산소원자는 독립적으로 존재하기보다 O2분자형태로 존재하는것이 안정하다).
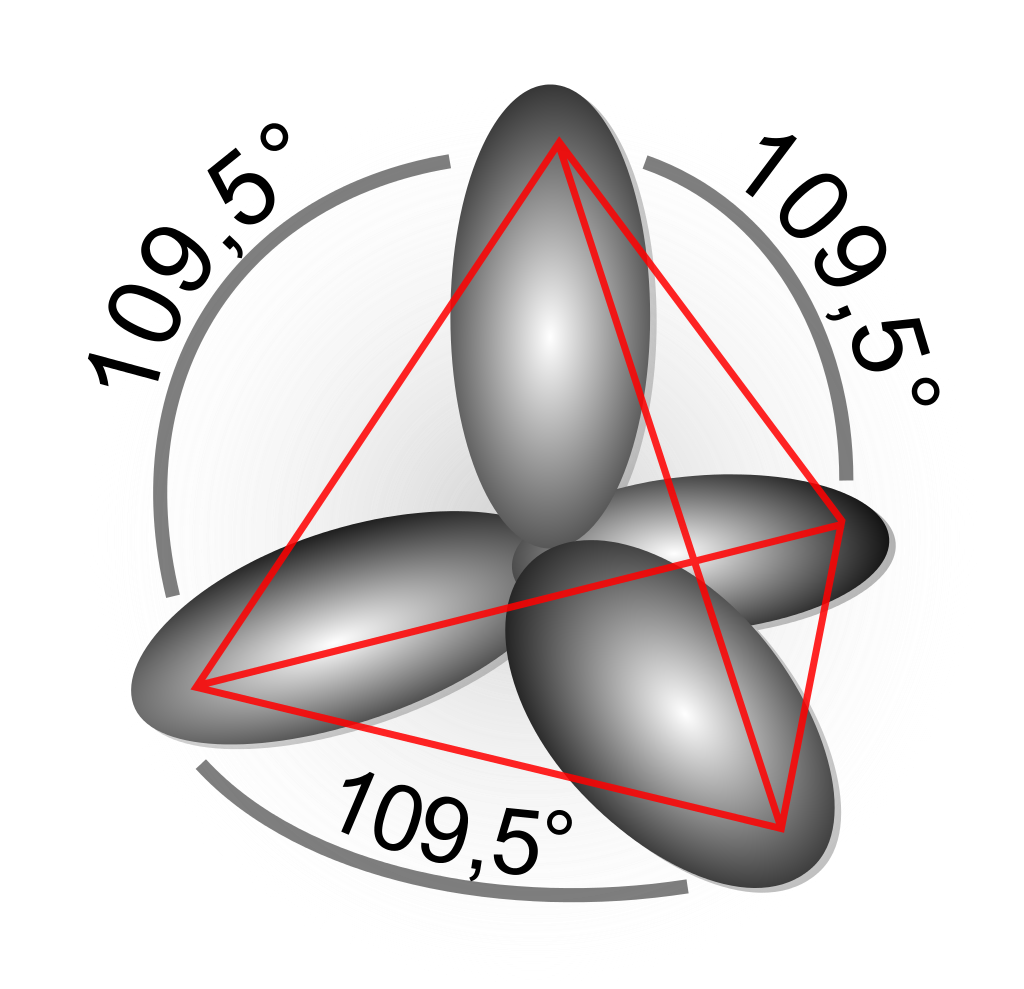
물분자의 공유결합과 남겨진 전자들의 행방
전자는 페르미온이기 때문에, 파울리 배타 원리에 따라 이 입자들이 정확히 같은 양자수(量子數)를 가질 수 없다. 따라서 같은 궤도(궤도 양자수)를 가질 유일한 방법은 자기 스핀 양자수에 차이가 있는 것이다. 이는 같은 궤도상의 전자 수를 정확히 2개로 제한한다. - 위키백과 -
옥텟 규칙(octet rule)은 분자를 이루는 각각의 원자는 전자가 최외각 껍질에 8개가 들어갔을 때 가장 안정된 상태라고 하는 화학 이론이다. 주로 2주기 원소에서 성립하는 규칙이다. - 위키백과 -
산소의 sp3 궤도에서 전자 2개는 수소원자의 전자와 각각 궤도를 공유하면서 sp3 궤도에 2개전자를 꽉 채운 모습이 된다. 산소는 수소와 공유한 전자 덕분에 최외각에 8개의 전자을 모두가진 안정한 상태가 된다. 결합하지 않은 나머지 전자들은 각자 다른 빈궤도로 밀려 그 자리를 차지하게되는데 공유결합으로 이뤄진 궤도를 제외한 나머지 2개의 sp3 궤도에 전자 2개가 각각 자리하게 된다. 마치 쌍을 이뤄 존재한는 것 처럼 말이다.
최종정리
1. 원자의 전자는 특정 궤도상에만 존재한다. (양자화 되어있다)
2. 같은 궤도에는 전자가 2개까지만 존재할 수 있다. (자기 스핀 양자수)
3. 물분자에서 공유결합을 하지 않은 산소의 비공유전자 전자 4개는 남은 2개의 sp3 궤도에 각각 2개씩 존재한다.
궁금한점
- 전자의 위치와 운동량을 동시에 정확히 측정 불가능함을 결론지은 하이젠베르크의 불확정성 원리란 정확히 무엇일까?
- 파울리 배타원리는 어떻게 입증된걸까?
- 마침 산소에 있던 최외각 전자들이 모두 업스핀 전자였다면 물분자는 어떤 모양이 될까?
'자연과학 > 화학' 카테고리의 다른 글
| 생명의 어머니, 물의 성질 (0) | 2022.12.07 |
|---|---|
| 산소 마스크 없는 배양캡슐액의 정체, 퍼플루오린화탄소 (2) | 2022.11.26 |
| pH(수소 이온 농도 지수) (0) | 2022.07.27 |
| 그대 만을 위한 오메가-3 (0) | 2022.07.15 |